Emplomado
Pseudocercospora cladosporioides
Categoría
Nombre de la enfermedad: Emplomado, repilo plomizo o cercosporiosis (en inglés: Cercospora leaf spot o cercosporiosis).
Tipo de enfermedad: Mancha o necrosis foliar.
Patógeno: Pseudocercospora cladosporioides (sinónimos: Cercospora cladosporioides, Mycocentrospora cladosporioides). Hongo asexual, ecológicamente biotrofo estricto y específico de Olea europaea, tanto del olivo cultivado como del silvestre o acebuche.
Clasificación del patógeno: Fungi, Ascomycota, Dothideomycetes, Mycosphaerellales, Mycosphaerellaceae.
Diagnóstico: Enfermedad de fácil diagnóstico en base a los síntomas y, sobre todo, los signos característicos, que se forman en el envés de las hojas. No obstante, puede confundirse con otras enfermedades foliares, como lepra o antracnosis, o incluso con deficiencia de potasio. Las infecciones latentes son habituales y la incubación de las hojas en cámara húmeda facilita su detección, pero solo cuando están muy desarrolladas. También se han desarrollado técnicas moleculares para la detección del patógeno, aunque no se utilizan habitualmente.
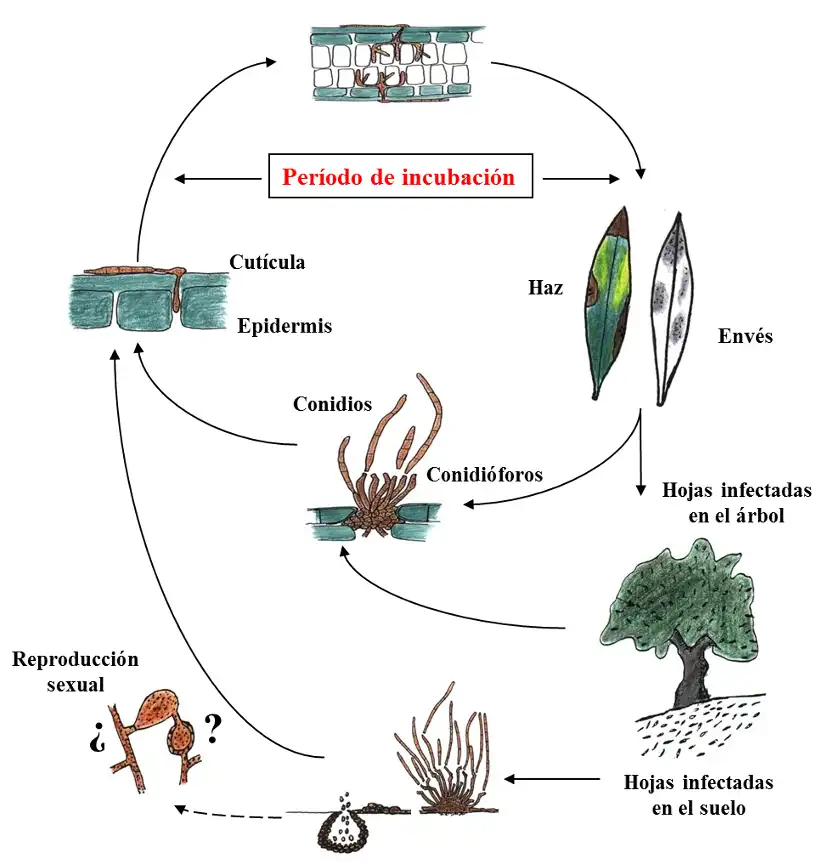
Ciclo biológico: Enfermedad monocíclica u oligocíclica, con ninguno o pocos ciclos secundarios de infección anuales, lo que determina un desarrollo lento anualmente pero exponencial con los años.
Métodos de control: Gestión integrada que incluye prácticas culturales, resistencia genética y fungicidas (especialmente productos cúpricos). No se dispone de medidas específicas de control biológico.
Comparte en redes sociales:





Debido a la similitud de los síntomas y al desconocimiento general de esta enfermedad, los daños causados por el emplomado del olivo se han atribuido con frecuencia al repilo causado por Spilocaea oleagina, o a la antracnosis o aceituna jabonosa causada por especies de Colletotrichum. Además, debido a los síntomas en el haz foliar, puede ser confundida con la clorosis férrica, con la deficiencia de potasio, o con la propia senescencia de la planta (Roca et al., 2017). Principalmente, afecta a las hojas, causando su caída prematura, lo que reduce la superficie fotosintética y, por consiguiente, los rendimientos en la cosecha de los árboles afectados. Cuando se repiten ataques graves de la enfermedad en años sucesivos, da lugar a la desecación y muerte de las ramas afectadas (Ávila et al., 2004a).
El patógeno infecta principalmente a las hojas. En condiciones muy favorables para la enfermedad también puede infectar a frutos, peciolos y pedúnculos. Los árboles afectados sufren una caída prematura de las hojas, dando lugar a defoliaciones importantes (Fig. 1A, B), sobre todo en años lluviosos. Esta caída prematura de las hojas origina un menor desarrollo de los brotes, menor tamaño de las aceitunas y una disminución importante de la floración del siguiente año, causando además un retraso en la maduración de la aceituna y una disminución de la calidad de los aceites obtenidos (García-Figueres, 1991; Ávila et al., 2005).
Los síntomas difieren en el haz y en el envés de las hojas. En el haz, consisten en manchas redondeadas o irregulares con tonalidades entre verde claro y amarillo que posteriormente se necrosan (Fig. 1C, D). Estas lesiones se localizan principalmente en los ápices y bordes de las hojas. En el envés, los síntomas son más específicos y consisten en manchas difusas de color grisáceo o plomizo debido a las fructificaciones del hongo (Fig. 1E, F) (Trapero et al., 2017b; Ávila et al., 2005), aspecto que da nombre a la enfermedad. En las hojas gravemente afectadas o caídas, la coloración grisácea del envés se acentúa y oscurece como consecuencia de la intensa esporulación del hongo, confundiéndose con frecuencia con ataques de negrilla (Ávila et al., 2004a; Trapero et al., 2017b).
Los síntomas en aceitunas varían en función del estado de madurez. En aceituna verde se desarrollan lesiones circulares de entre 3 y 7 mm de diámetro, deprimidas, de color ocre o marrón, y que adquieren tonalidades grisáceas o azuladas a medida que se van desarrollando (Fig. 1G). En aceitunas maduras, se observan áreas de mayor tamaño de aspecto gris ceniciento rodeadas en ocasiones con un halo amarillento (Fig. 1H, I). La pulpa se vuelve corchosa y oscura, y tiende a ahuecarse (Trapero et al., 2017).

El patógeno causante del emplomado del olivo fue identificado por primera vez por Saccardo en 1882 en Italia como Cercospora cladosporioides. Años más tarde, esta especie fue reclasificada con el nombre de Mycocentrospora cladosporioides (Sacc.) Deighton y posteriormente como Pseudocercospora cladosporiodies (Sacc.) U. Braun, nombre con el que se le conoce actualmente. El género Pseudocercospora engloba un amplio número de especies de hongos fitopatógenos, comúnmente asociados con síntomas de lesiones necróticas en hojas y frutos en un amplio rango de hospedantes. Estos hongos los podemos encontrar en zonas áridas, así como en ambientes húmedos y en un amplio rango de climas, incluyendo climas fríos, subtropicales y tropicales (Crous et al., 2013).
En la última década, se han llevado a cabo estudios de caracterización morfológica de aislados representativos de P. cladosporioides obtenidos principalmente de árboles afectados en Andalucía (Ávila et al., 2004b). Además, para comparar diferencias morfológicas entre especies, se estudiaron también aislados de P. ceratoniae procedentes de algarrobo. Los resultados obtenidos mostraron que los aislados de P. cladosporioides desarrollaban colonias de micelio que variaban de color gris a verde oliva (Fig. 2A, B) observándose dos tipos de micelio en función de las hifas, uno con hifas delgadas y otro con hifas más gruesas (Fig. 2C, D). Las esporas de P. cladosporioides se caracterizan por ser hialinas, septadas, ligeramente curvadas en el ápice y, en ocasiones, truncadas en la base, con una relación longitud-anchura (10-18,7 μm) (Fig. 2 E, F) menor a la observada en P. ceratoniae (13,4-32,1 μm) (Fig. 2G) (Ávila, 2005). Estas se forman sobre conidióforos rectos o ligeramente curvados, los cuales emergen de un estroma basal. Los conidióforos son de color marrón claro y el estroma más oscuro (Ávila et al., 2004a).
La presencia de clamidosporas, estructuras de resistencia frente a condiciones adversas, es poco frecuente. Estas se caracterizan por ser bicelulares con paredes gruesas (García-Figueres, 1991; Ávila et al., 2004a).
El estado sexual no se conoce, aunque en ocasiones se ha observado, tanto en medio de cultivo como en hojas afectadas, la presencia de cuerpos fructíferos que podrían ser espermogonios productores de espermacias (Trapero et al., 1998). Dichos espermogonios forman parte de la reproducción sexual de numerosos hongos, aunque en el caso de P. cladosporioides no se ha detectado la fase ascógena correspondiente al estado sexual (Ávila, 2005).

El ciclo de la enfermedad ha sido poco estudiado. Generalmente, se ha considerado que el ciclo del emplomado es similar al del repilo, ya que con frecuencia transcurre de forma simultánea en el mismo árbol al ciclo de V. oleaginea, agente causal del repilo del olivo (Trapero et al., 2017b).
El desarrollo y la duración del ciclo de patogénesis del emplomado dependen en gran medida de las condiciones de humedad, temperatura, localización y características del suelo. La infección es particularmente grave en plantaciones densas, con poca aireación, y se limita en muchos casos a la parte más baja del árbol. Esto es debido al microclima más húmedo y mayor abundancia de inóculo en esta parte del árbol y a la proximidad a las hojas caídas al suelo que pueden servir de inóculo primario cuando las condiciones de humedad y temperatura son favorables para la infección. Además, el hongo es capaz de sobrevivir en las hojas infectadas del árbol durante largos periodos de tiempo como infecciones latentes, o bien mediante estructuras de resistencia, pseudoesclerocios, especialmente cuando las condiciones ambientales son desfavorables (Ávila et al., 2004a).
Los conidios producidos en las lesiones cuando el agua está presente, o la humedad relativa es elevada, suponen el medio principal de multiplicación y dispersión del patógeno. Posteriormente, la infección se propaga de hoja en hoja, por medio de conidios o trozos de micelio, estableciéndose la enfermedad sobre las hojas del año precedente. Los conidios están adaptados para dispersarse a corta distancia, bien mediante salpicaduras de gotas de lluvia o por el viento, siempre que las condiciones de humedad sean favorables (Ávila et al., 2004).
Para dilucidar el ciclo biológico del patógeno, se han llevado a cabo estudios en los que se ha evaluado la evolución de la enfermedad durante cuatro años consecutivos en dos campos experimentales localizados en Córdoba. Durante este tiempo, se ha observado claramente que la severidad de la enfermedad varía con la estación del año, y en función de la temperatura, la humedad relativa y las precipitaciones (Fig. 3). El periodo epidémico abarca desde finales de octubre a principios de primavera, coincidiendo con los periodos de lluvias y temperaturas por debajo de 20 °C. La aparición de los primeros síntomas de la enfermedad tiene lugar en otoño con las primeras lluvias, alcanzando los valores máximos de intensidad en diciembre y enero. En los meses sucesivos, los síntomas de la enfermedad progresan, observándose los síntomas típicos del emplomado con manchas en el envés de las hojas de color gris ceniciento. En primavera se observa un segundo momento de infección del patógeno, pero no parece tan importante como en otoño. Finalmente, las hojas afectadas caen al suelo de forma gradual a medida que avanza el desarrollo de la enfermedad, aunque la mayor caída de hojas tiene lugar al principio del verano con el aumento de las temperaturas (Fig. 4). Por consiguiente, el inicio de la defoliación coincide con el periodo de maduración de la aceituna, originando el debilitamiento del árbol e influyendo en el rendimiento y calidad de la cosecha (Ávila, 2005; Romero et al., 2020).
Las infecciones por P. cladosporioides se caracterizan por presentar un largo periodo de incubación. Ensayos de patogenicidad llevados a cabo bajo diferentes condiciones ambientales, han demostrado que el período mínimo de incubación necesario para desarrollar síntomas es de al menos 7 días en frutos y 30 días en hojas separadas del árbol. Sin embargo, en plantones de olivo inoculados, el periodo de incubación de las infecciones foliares se prolonga hasta más de 10 meses, coincidiendo frecuentemente con el periodo de latencia, que concluye con la aparición de la esporulación del hongo en las lesiones. Por ello, los síntomas de la enfermedad se observan principalmente en hojas viejas, aunque la infección ocurre en hojas jóvenes (<1 año) (Ávila, 2005; Ávila et al., 2020). Los estudios de caracterización del agente llevados a cabo ponen de manifiesto un amplio rango de temperaturas en las que puede desarrollarse el patógeno. El micelio del hongo muestra un buen desarrollo a temperaturas comprendidas entre 15 y 25 ºC, siendo la temperatura óptima de crecimiento 21 ºC. En cuanto a la germinación de conidios, estos muestran un elevado porcentaje de germinación a temperaturas comprendidas entre 15 y 25 ºC (Ávila, 2005). Estos datos confirman la buena adaptación de P. cladosporioides al clima mediterráneo.

Debido a la escasez de información sobre la biología y epidemiología de la enfermedad, tradicionalmente, la estrategia para la lucha contra el emplomado ha sido la misma que la utilizada para otras enfermedades foliares del olivo, como el repilo, basándose principalmente en la aplicación de fungicidas cúpricos. Sin embargo, los avances que se han producido en las dos últimas décadas en la investigación sobre la biología y epidemiología de esta enfermedad han permitido el desarrollo de estrategias de control específicas para el emplomado.
Prácticas culturales
Además del control químico, es importante tener en cuenta las prácticas culturales que permitan la prevención de la enfermedad dentro del marco de la gestión integrada del cultivo. En este sentido, se recomiendan las medidas culturales que favorezcan la ventilación de los árboles y disminuyan el tiempo de humectación foliar. Se aconseja no establecer plantaciones de olivar cerca de ríos, arroyos y zonas húmedas para evitar humedades elevadas. Se deben practicar podas selectivas y establecer marcos de plantación adecuados para evitar copas densas o muy juntas. Asimismo, se recomienda la eliminación de fuentes de inóculo, principalmente las hojas infectadas caídas al suelo (Ávila et al., 2004).
Resistencia genética
Otro aspecto importante a tener en cuenta es la resistencia o la susceptibilidad varietal. En España, y concretamente en Andalucía, casi todos los cultivares principales se han visto afectados en mayor o menor grado por la enfermedad, siendo ‘Lechín de Sevilla’, que es resistente al repilo, uno de los más susceptibles. Otros cultivares bastante susceptibles son ‘Hojiblanca’ y ‘Frantoio’. El cultivar más común en Andalucía, ‘Picual’, es poco susceptible a la enfermedad, y entre los menos susceptibles destacan ‘Arbequina’, ‘Blanqueta’ y ‘Verdial de Vélez-Málaga’. En la Tabla 1 se resume la reacción de 53 cultivares del Banco de Germoplasma de Córdoba evaluada en condiciones de infección natural durante 4 años el periodo 1997-2005. Aunque los cultivares se han podido agrupar en cinco categorías de susceptibilidad, hay que destacar que la respuesta ha sido variable entre años, e incluso entre repeticiones, lo que limita la validez de esta clasificación. Ello ha sido especialmente destacado en algunos cultivares, como ‘Arbosana’, ‘Empeltre’ y ‘Manzanilla de Sevilla’ (Tabla 1).
Tabla 1. Susceptibilidad de cultivares de olivo al Emplomado1.
| Categoría | Cultivar |
|---|---|
| Altamente resistente (AR) | Alameño de Marchena, Alfafara, Cobrançosa, Manzanilla de Hellín, Manzanilla del Piquito, Megaritiki, Pequeña de Casa Ibáñez, Racimal de Jaén, Verdial de Vélez-Málaga |
| Resistente (R) | Arbequina, Blanqueta, Cornicabra de Mérida, Empeltre*, Farga, Galega Vulgar, Manzanilla de Agua, Manzanilla de Guadix, Manzanilla de Jaén, Manzanilla de Sevilla*, Manzanilla de Tortosa, Meski, Nabali, Picholine Marroquí, Picual |
| Moderadamente susceptible (M) | Callosina, Leccino, Manzanilla del Centro, Morisca, Morrut, Ocal, Pajarero, Picual de Estepa, Picudo de Montoro |
| Susceptible (S) | Changlot Real, Cornicabra, Dolce Agogia, Frantoio, Gordal Sevillana, Hojiblanca, Koroneiki, Lechín de Granada, Perillo de Jaén, Picholine, Sevillenca, Villalonga |
| Altamente susceptible (AS) | Arbosana*, Cipresino, Lechín de Sevilla, Manzanilla Cacereña, Picual de Hoja Clara, Picudo, Picudo de Fruto Rojo, Verdial de Huévar |
1Evaluaciones realizadas durante cuatro años en el período 1997-2005 en condiciones de infección natural en el Banco de Germoplasma de Olivo y en parcelas experimentales de Córdoba (Ávila, 2005; Moral et al., 2005).
*Cultivares que mostraron una respuesta muy variable con los años o repeticiones.
Asimismo, entre las selecciones avanzadas de olivo procedentes en el programa de mejora del olivo de Córdoba, se disponen de algunos nuevos genotipos con resistencia o tolerancia al emplomado, ya que se han incluido cultivares resistentes entre los parentales utilizados para los cruzamientos (Moral et al., 2015).
Control químico
Tradicionalmente, para el control químico del emplomado del olivo se han seguido las mismas estrategias de control empleadas para combatir el repilo, basándose principalmente en aplicaciones foliares de compuestos cúpricos o en mezclas de estos con fungicidas sistémicos (Roca et al., 2007). No obstante, en los últimos años, en el Grupo de Patología Agroforestal de la Universidad de Córdoba (UCO) se han realizado estudios con el objetivo de establecer estrategias de control de la enfermedad dentro del marco de la gestión integrada.
En este sentido, ha evaluado un total de 14 productos entre compuestos cúpricos, y fungicidas protectores y sistémicos, según su eficacia en la inhibición del crecimiento micelial y la germinación de conidios de P. cladosporioides. Los triazoles y las estrobilurinas han resultado altamente efectivos en la inhibición del crecimiento micelial y de la germinación de conidios, con una dosis inhibitoria del 50% de 0,1 y menor de 0,05 ppm, respectivamente. Los compuestos cúpricos han mostrado una eficacia generalizada, mientras que los protectores orgánicos tienen un efecto más variable, siendo el folpet el fungicida más eficaz dentro de este grupo. Los productos más eficaces en los ensayos in vitro se evaluaron en condiciones de campo, donde se observó que las estrobilurinas consiguen disminuir significativamente el nivel de enfermedad sin necesidad de usar fungicidas cúpricos en sus mezclas. Además, en 14 fincas de olivar y durante 5 años se han estudiado dos estrategias de control, basadas en el conocimiento epidemiológico disponible sobre los “repilos”, con el objetivo de mantener o disminuir el nivel de enfermedad en campo, reduciendo el número de aplicaciones fitosanitarias respecto al manejo tradicional. En estos estudios, se ha podido concluir que las aplicaciones de mezclas de cobre con estrobilurinas, o incluso la aplicación única de estos últimos, principalmente en el periodo de infección de primavera, y en otoño, en el caso de que se den condiciones favorables para el emplomado (> 1% de incidencia al principio del otoño), son suficientes para prevenir o mantener niveles bajos de la enfermedad (Ávila et al., 2005; Romero et al., 2020).
Debido a la gravedad de esta enfermedad, que además de la defoliación que ocasiona, ataca también directamente al fruto, se sigue investigando con el objetivo de mejorar las estrategias específicas de control integrado del emplomado del olivo. En este sentido, mediante un convenio con la empresa Bayer CropScience, se están llevando a cabo estudios de modelización de las epidemias de las principales micosis del olivar, incluidas en el complejo “Repilos”, entre las que se encuentra el emplomado. Mediante este convenio se pretende desarrollar un modelo predictivo de los periodos favorables al desarrollo epidémico de cada una de estas enfermedades en función de las condiciones ambientales, que permitirá en un futuro próximo conocer a tiempo real en qué momento existe riesgo de infección y por consiguiente establecer el momento óptimo de aplicaciones fitosanitarias (Romero et al., 2017). Esta herramienta, junto con los estudios de eficacia de fungicidas realizados hasta el momento, supondría un gran avance para el control de la enfermedad dentro del marco de la gestión integrada con vista a las futuras normativas previstas de reducción anual de dosis de cobre en el olivar.
Ávila, A. 2005. Etiología y epidemiología del Emplomado del olivo causado por Pseudocercospora cladosporioides. Tesis Doctoral. ETSIAM. Universidad de Córdoba.
Ávila, A., Benali, A., Trapero, A. 2004a. El emplomado del olivo, una grave enfermedad poco conocida. Vida Rural 198: 32-36.
Ávila, A., Benali, A., Trapero, A. 2004b. Variabilidad morfológica y cultural de Pseudocercospora cladosporioides, agente del emplomado del olivo. Bol. San. Veg. Plagas 30: 223-238.
Ávila, A., Romero, J., Agustí-Brisach, C., Benali, A., Roca, L.F., Trapero, A. 2020. Phenotypic and pathogenic characterization of Pseudocercospora cladosporioides, causal agent of Cercospora leaf spot of olives. Eur. J. Plant Pathol. 156: 45-65.
Ávila, A., Groenewald, J., Trapero, A., Crous, P. 2005. Characterisation and epitypification of Pseudocercospora cladosporioides, the causal organism of Cercospora leaf spot of olives. Mycol. Research 109: 881-888.
Crous, P.W., Braun, U., Hunter, G. C., Wingfield, M. J., Verkley, G. J. M., Shin, H. D., Nakashima, C., Groenewald, J. Z. 2013. Phylogenetic lineages in Pseudocercospora. Stud. Mycol. 75: 37–114.
Del Moral, J., Medina, D. 1985. El «repilo plomizo» del olivo causado por Cercospora cladosporioides Sacc., enfermedad presente en España. Bol. San. Veg. Plagas 12: 31-35.
García-Figueres, F. 1991. Repilos del olivo: ataque en fruto. Phytoma España 25: 31-36.
Moral, J., Alsalimiya, M., Roca, L.F., Díez, C., León, L., De la Rosa, R., Barranco, D., Rallo, L., Trapero, A. 2015. Relative susceptibility of new olive cultivars to Spilocaea oleagina, Colletotrichum acutatum, and Pseudocercospora cladosporioides. Plant Dis. 99:58-64.
Roca, L.F., Agustí-Brisach, C., Romero, J., Moral, J., Raya, M.C., Trapero, A. 2017. Diagnóstico y etiología de la «seca» de ramas de olivo (I y II). Vida Rural 437: 52-58 y 438: 48-53.
Roca, L.F., Viruega, J.R., Ávila, A., Oliveira, R., Marchal, F., Moral, J., Trapero, A. 2007. Los fungicidas cúpricos en el control de las enfermedades del olivo. Vida Rural 256: 52-56.
Romero, J., Ávila, A., Agustí-Brisach, C., Roca, L.F., Trapero, A. 2020. Evaluation of fungicides and management strategies against cercospora leaf spot of olive caused by Pseudocercospora cladosporioides. Agronomy 10: 271.
Romero, J., Roca, L.F., Agustí-Brisach, C., Trapero, A., González-Domínguez, E., Rossi, V. 2017. Sistema informático de apoyo al olivicultor: herramienta de toma de decisiones «Repilos». Phytoma 293:126-129.
Trapero, A., Agustí-Brisach, C., Romero, J., Moral, J., Roca, L.F. 2017a. Enfermedades emergentes en el olivar. Phytoma España 293: 26-32.
Trapero-Casas, A., López-Doncel, L.M., Viruega-Puente, J.R. 1998. Los repilos del olivo: etiología, epidemiología y estrategias de control. Phytoma España 102: 154-158.
Trapero, A., López-Escudero, F.J., Blanco, M.A. 2017b. Enfermedades. Barranco, D., Fernández-Escobar, R., Rallo, L. eds. El cultivo del olivo. 7ª edición. Mundi-Prensa, Madrid, 733-798 pp.
Debido a la similitud de los síntomas y al desconocimiento general de esta enfermedad, los daños causados por el emplomado del olivo se han atribuido con frecuencia al repilo causado por Spilocaea oleagina, o a la antracnosis o aceituna jabonosa causada por especies de Colletotrichum. Además, debido a los síntomas en el haz foliar, puede ser confundida con la clorosis férrica, con la deficiencia de potasio, o con la propia senescencia de la planta (Roca et al., 2017). Principalmente, afecta a las hojas, causando su caída prematura, lo que reduce la superficie fotosintética y, por consiguiente, los rendimientos en la cosecha de los árboles afectados. Cuando se repiten ataques graves de la enfermedad en años sucesivos, da lugar a la desecación y muerte de las ramas afectadas (Ávila et al., 2004a).
El patógeno infecta principalmente a las hojas. En condiciones muy favorables para la enfermedad también puede infectar a frutos, peciolos y pedúnculos. Los árboles afectados sufren una caída prematura de las hojas, dando lugar a defoliaciones importantes (Fig. 1A, B), sobre todo en años lluviosos. Esta caída prematura de las hojas origina un menor desarrollo de los brotes, menor tamaño de las aceitunas y una disminución importante de la floración del siguiente año, causando además un retraso en la maduración de la aceituna y una disminución de la calidad de los aceites obtenidos (García-Figueres, 1991; Ávila et al., 2005).
Los síntomas difieren en el haz y en el envés de las hojas. En el haz, consisten en manchas redondeadas o irregulares con tonalidades entre verde claro y amarillo que posteriormente se necrosan (Fig. 1C, D). Estas lesiones se localizan principalmente en los ápices y bordes de las hojas. En el envés, los síntomas son más específicos y consisten en manchas difusas de color grisáceo o plomizo debido a las fructificaciones del hongo (Fig. 1E, F) (Trapero et al., 2017b; Ávila et al., 2005), aspecto que da nombre a la enfermedad. En las hojas gravemente afectadas o caídas, la coloración grisácea del envés se acentúa y oscurece como consecuencia de la intensa esporulación del hongo, confundiéndose con frecuencia con ataques de negrilla (Ávila et al., 2004a; Trapero et al., 2017b).
Los síntomas en aceitunas varían en función del estado de madurez. En aceituna verde se desarrollan lesiones circulares de entre 3 y 7 mm de diámetro, deprimidas, de color ocre o marrón, y que adquieren tonalidades grisáceas o azuladas a medida que se van desarrollando (Fig. 1G). En aceitunas maduras, se observan áreas de mayor tamaño de aspecto gris ceniciento rodeadas en ocasiones con un halo amarillento (Fig. 1H, I). La pulpa se vuelve corchosa y oscura, y tiende a ahuecarse (Trapero et al., 2017).

El patógeno causante del emplomado del olivo fue identificado por primera vez por Saccardo en 1882 en Italia como Cercospora cladosporioides. Años más tarde, esta especie fue reclasificada con el nombre de Mycocentrospora cladosporioides (Sacc.) Deighton y posteriormente como Pseudocercospora cladosporiodies (Sacc.) U. Braun, nombre con el que se le conoce actualmente. El género Pseudocercospora engloba un amplio número de especies de hongos fitopatógenos, comúnmente asociados con síntomas de lesiones necróticas en hojas y frutos en un amplio rango de hospedantes. Estos hongos los podemos encontrar en zonas áridas, así como en ambientes húmedos y en un amplio rango de climas, incluyendo climas fríos, subtropicales y tropicales (Crous et al., 2013).
En la última década, se han llevado a cabo estudios de caracterización morfológica de aislados representativos de P. cladosporioides obtenidos principalmente de árboles afectados en Andalucía (Ávila et al., 2004b). Además, para comparar diferencias morfológicas entre especies, se estudiaron también aislados de P. ceratoniae procedentes de algarrobo. Los resultados obtenidos mostraron que los aislados de P. cladosporioides desarrollaban colonias de micelio que variaban de color gris a verde oliva (Fig. 2A, B) observándose dos tipos de micelio en función de las hifas, uno con hifas delgadas y otro con hifas más gruesas (Fig. 2C, D). Las esporas de P. cladosporioides se caracterizan por ser hialinas, septadas, ligeramente curvadas en el ápice y, en ocasiones, truncadas en la base, con una relación longitud-anchura (10-18,7 μm) (Fig. 2 E, F) menor a la observada en P. ceratoniae (13,4-32,1 μm) (Fig. 2G) (Ávila, 2005). Estas se forman sobre conidióforos rectos o ligeramente curvados, los cuales emergen de un estroma basal. Los conidióforos son de color marrón claro y el estroma más oscuro (Ávila et al., 2004a).
La presencia de clamidosporas, estructuras de resistencia frente a condiciones adversas, es poco frecuente. Estas se caracterizan por ser bicelulares con paredes gruesas (García-Figueres, 1991; Ávila et al., 2004a).
El estado sexual no se conoce, aunque en ocasiones se ha observado, tanto en medio de cultivo como en hojas afectadas, la presencia de cuerpos fructíferos que podrían ser espermogonios productores de espermacias (Trapero et al., 1998). Dichos espermogonios forman parte de la reproducción sexual de numerosos hongos, aunque en el caso de P. cladosporioides no se ha detectado la fase ascógena correspondiente al estado sexual (Ávila, 2005).

El ciclo de la enfermedad ha sido poco estudiado. Generalmente, se ha considerado que el ciclo del emplomado es similar al del repilo, ya que con frecuencia transcurre de forma simultánea en el mismo árbol al ciclo de V. oleaginea, agente causal del repilo del olivo (Trapero et al., 2017b).
El desarrollo y la duración del ciclo de patogénesis del emplomado dependen en gran medida de las condiciones de humedad, temperatura, localización y características del suelo. La infección es particularmente grave en plantaciones densas, con poca aireación, y se limita en muchos casos a la parte más baja del árbol. Esto es debido al microclima más húmedo y mayor abundancia de inóculo en esta parte del árbol y a la proximidad a las hojas caídas al suelo que pueden servir de inóculo primario cuando las condiciones de humedad y temperatura son favorables para la infección. Además, el hongo es capaz de sobrevivir en las hojas infectadas del árbol durante largos periodos de tiempo como infecciones latentes, o bien mediante estructuras de resistencia, pseudoesclerocios, especialmente cuando las condiciones ambientales son desfavorables (Ávila et al., 2004a).
Los conidios producidos en las lesiones cuando el agua está presente, o la humedad relativa es elevada, suponen el medio principal de multiplicación y dispersión del patógeno. Posteriormente, la infección se propaga de hoja en hoja, por medio de conidios o trozos de micelio, estableciéndose la enfermedad sobre las hojas del año precedente. Los conidios están adaptados para dispersarse a corta distancia, bien mediante salpicaduras de gotas de lluvia o por el viento, siempre que las condiciones de humedad sean favorables (Ávila et al., 2004).
Para dilucidar el ciclo biológico del patógeno, se han llevado a cabo estudios en los que se ha evaluado la evolución de la enfermedad durante cuatro años consecutivos en dos campos experimentales localizados en Córdoba. Durante este tiempo, se ha observado claramente que la severidad de la enfermedad varía con la estación del año, y en función de la temperatura, la humedad relativa y las precipitaciones (Fig. 3). El periodo epidémico abarca desde finales de octubre a principios de primavera, coincidiendo con los periodos de lluvias y temperaturas por debajo de 20 °C. La aparición de los primeros síntomas de la enfermedad tiene lugar en otoño con las primeras lluvias, alcanzando los valores máximos de intensidad en diciembre y enero. En los meses sucesivos, los síntomas de la enfermedad progresan, observándose los síntomas típicos del emplomado con manchas en el envés de las hojas de color gris ceniciento. En primavera se observa un segundo momento de infección del patógeno, pero no parece tan importante como en otoño. Finalmente, las hojas afectadas caen al suelo de forma gradual a medida que avanza el desarrollo de la enfermedad, aunque la mayor caída de hojas tiene lugar al principio del verano con el aumento de las temperaturas (Fig. 4). Por consiguiente, el inicio de la defoliación coincide con el periodo de maduración de la aceituna, originando el debilitamiento del árbol e influyendo en el rendimiento y calidad de la cosecha (Ávila, 2005; Romero et al., 2020).
Las infecciones por P. cladosporioides se caracterizan por presentar un largo periodo de incubación. Ensayos de patogenicidad llevados a cabo bajo diferentes condiciones ambientales, han demostrado que el período mínimo de incubación necesario para desarrollar síntomas es de al menos 7 días en frutos y 30 días en hojas separadas del árbol. Sin embargo, en plantones de olivo inoculados, el periodo de incubación de las infecciones foliares se prolonga hasta más de 10 meses, coincidiendo frecuentemente con el periodo de latencia, que concluye con la aparición de la esporulación del hongo en las lesiones. Por ello, los síntomas de la enfermedad se observan principalmente en hojas viejas, aunque la infección ocurre en hojas jóvenes (<1 año) (Ávila, 2005; Ávila et al., 2020). Los estudios de caracterización del agente llevados a cabo ponen de manifiesto un amplio rango de temperaturas en las que puede desarrollarse el patógeno. El micelio del hongo muestra un buen desarrollo a temperaturas comprendidas entre 15 y 25 ºC, siendo la temperatura óptima de crecimiento 21 ºC. En cuanto a la germinación de conidios, estos muestran un elevado porcentaje de germinación a temperaturas comprendidas entre 15 y 25 ºC (Ávila, 2005). Estos datos confirman la buena adaptación de P. cladosporioides al clima mediterráneo.

Debido a la escasez de información sobre la biología y epidemiología de la enfermedad, tradicionalmente, la estrategia para la lucha contra el emplomado ha sido la misma que la utilizada para otras enfermedades foliares del olivo, como el repilo, basándose principalmente en la aplicación de fungicidas cúpricos. Sin embargo, los avances que se han producido en las dos últimas décadas en la investigación sobre la biología y epidemiología de esta enfermedad han permitido el desarrollo de estrategias de control específicas para el emplomado.
Prácticas culturales
Además del control químico, es importante tener en cuenta las prácticas culturales que permitan la prevención de la enfermedad dentro del marco de la gestión integrada del cultivo. En este sentido, se recomiendan las medidas culturales que favorezcan la ventilación de los árboles y disminuyan el tiempo de humectación foliar. Se aconseja no establecer plantaciones de olivar cerca de ríos, arroyos y zonas húmedas para evitar humedades elevadas. Se deben practicar podas selectivas y establecer marcos de plantación adecuados para evitar copas densas o muy juntas. Asimismo, se recomienda la eliminación de fuentes de inóculo, principalmente las hojas infectadas caídas al suelo (Ávila et al., 2004).
Resistencia genética
Otro aspecto importante a tener en cuenta es la resistencia o la susceptibilidad varietal. En España, y concretamente en Andalucía, casi todos los cultivares principales se han visto afectados en mayor o menor grado por la enfermedad, siendo ‘Lechín de Sevilla’, que es resistente al repilo, uno de los más susceptibles. Otros cultivares bastante susceptibles son ‘Hojiblanca’ y ‘Frantoio’. El cultivar más común en Andalucía, ‘Picual’, es poco susceptible a la enfermedad, y entre los menos susceptibles destacan ‘Arbequina’, ‘Blanqueta’ y ‘Verdial de Vélez-Málaga’. En la Tabla 1 se resume la reacción de 53 cultivares del Banco de Germoplasma de Córdoba evaluada en condiciones de infección natural durante 4 años el periodo 1997-2005. Aunque los cultivares se han podido agrupar en cinco categorías de susceptibilidad, hay que destacar que la respuesta ha sido variable entre años, e incluso entre repeticiones, lo que limita la validez de esta clasificación. Ello ha sido especialmente destacado en algunos cultivares, como ‘Arbosana’, ‘Empeltre’ y ‘Manzanilla de Sevilla’ (Tabla 1).
Tabla 1. Susceptibilidad de cultivares de olivo al Emplomado1.
| Categoría | Cultivar |
|---|---|
| Altamente resistente (AR) | Alameño de Marchena, Alfafara, Cobrançosa, Manzanilla de Hellín, Manzanilla del Piquito, Megaritiki, Pequeña de Casa Ibáñez, Racimal de Jaén, Verdial de Vélez-Málaga |
| Resistente (R) | Arbequina, Blanqueta, Cornicabra de Mérida, Empeltre*, Farga, Galega Vulgar, Manzanilla de Agua, Manzanilla de Guadix, Manzanilla de Jaén, Manzanilla de Sevilla*, Manzanilla de Tortosa, Meski, Nabali, Picholine Marroquí, Picual |
| Moderadamente susceptible (M) | Callosina, Leccino, Manzanilla del Centro, Morisca, Morrut, Ocal, Pajarero, Picual de Estepa, Picudo de Montoro |
| Susceptible (S) | Changlot Real, Cornicabra, Dolce Agogia, Frantoio, Gordal Sevillana, Hojiblanca, Koroneiki, Lechín de Granada, Perillo de Jaén, Picholine, Sevillenca, Villalonga |
| Altamente susceptible (AS) | Arbosana*, Cipresino, Lechín de Sevilla, Manzanilla Cacereña, Picual de Hoja Clara, Picudo, Picudo de Fruto Rojo, Verdial de Huévar |
1Evaluaciones realizadas durante cuatro años en el período 1997-2005 en condiciones de infección natural en el Banco de Germoplasma de Olivo y en parcelas experimentales de Córdoba (Ávila, 2005; Moral et al., 2005).
*Cultivares que mostraron una respuesta muy variable con los años o repeticiones.
Asimismo, entre las selecciones avanzadas de olivo procedentes en el programa de mejora del olivo de Córdoba, se disponen de algunos nuevos genotipos con resistencia o tolerancia al emplomado, ya que se han incluido cultivares resistentes entre los parentales utilizados para los cruzamientos (Moral et al., 2015).
Control químico
Tradicionalmente, para el control químico del emplomado del olivo se han seguido las mismas estrategias de control empleadas para combatir el repilo, basándose principalmente en aplicaciones foliares de compuestos cúpricos o en mezclas de estos con fungicidas sistémicos (Roca et al., 2007). No obstante, en los últimos años, en el Grupo de Patología Agroforestal de la Universidad de Córdoba (UCO) se han realizado estudios con el objetivo de establecer estrategias de control de la enfermedad dentro del marco de la gestión integrada.
En este sentido, ha evaluado un total de 14 productos entre compuestos cúpricos, y fungicidas protectores y sistémicos, según su eficacia en la inhibición del crecimiento micelial y la germinación de conidios de P. cladosporioides. Los triazoles y las estrobilurinas han resultado altamente efectivos en la inhibición del crecimiento micelial y de la germinación de conidios, con una dosis inhibitoria del 50% de 0,1 y menor de 0,05 ppm, respectivamente. Los compuestos cúpricos han mostrado una eficacia generalizada, mientras que los protectores orgánicos tienen un efecto más variable, siendo el folpet el fungicida más eficaz dentro de este grupo. Los productos más eficaces en los ensayos in vitro se evaluaron en condiciones de campo, donde se observó que las estrobilurinas consiguen disminuir significativamente el nivel de enfermedad sin necesidad de usar fungicidas cúpricos en sus mezclas. Además, en 14 fincas de olivar y durante 5 años se han estudiado dos estrategias de control, basadas en el conocimiento epidemiológico disponible sobre los “repilos”, con el objetivo de mantener o disminuir el nivel de enfermedad en campo, reduciendo el número de aplicaciones fitosanitarias respecto al manejo tradicional. En estos estudios, se ha podido concluir que las aplicaciones de mezclas de cobre con estrobilurinas, o incluso la aplicación única de estos últimos, principalmente en el periodo de infección de primavera, y en otoño, en el caso de que se den condiciones favorables para el emplomado (> 1% de incidencia al principio del otoño), son suficientes para prevenir o mantener niveles bajos de la enfermedad (Ávila et al., 2005; Romero et al., 2020).
Debido a la gravedad de esta enfermedad, que además de la defoliación que ocasiona, ataca también directamente al fruto, se sigue investigando con el objetivo de mejorar las estrategias específicas de control integrado del emplomado del olivo. En este sentido, mediante un convenio con la empresa Bayer CropScience, se están llevando a cabo estudios de modelización de las epidemias de las principales micosis del olivar, incluidas en el complejo “Repilos”, entre las que se encuentra el emplomado. Mediante este convenio se pretende desarrollar un modelo predictivo de los periodos favorables al desarrollo epidémico de cada una de estas enfermedades en función de las condiciones ambientales, que permitirá en un futuro próximo conocer a tiempo real en qué momento existe riesgo de infección y por consiguiente establecer el momento óptimo de aplicaciones fitosanitarias (Romero et al., 2017). Esta herramienta, junto con los estudios de eficacia de fungicidas realizados hasta el momento, supondría un gran avance para el control de la enfermedad dentro del marco de la gestión integrada con vista a las futuras normativas previstas de reducción anual de dosis de cobre en el olivar.
Ávila, A. 2005. Etiología y epidemiología del Emplomado del olivo causado por Pseudocercospora cladosporioides. Tesis Doctoral. ETSIAM. Universidad de Córdoba.
Ávila, A., Benali, A., Trapero, A. 2004a. El emplomado del olivo, una grave enfermedad poco conocida. Vida Rural 198: 32-36.
Ávila, A., Benali, A., Trapero, A. 2004b. Variabilidad morfológica y cultural de Pseudocercospora cladosporioides, agente del emplomado del olivo. Bol. San. Veg. Plagas 30: 223-238.
Ávila, A., Romero, J., Agustí-Brisach, C., Benali, A., Roca, L.F., Trapero, A. 2020. Phenotypic and pathogenic characterization of Pseudocercospora cladosporioides, causal agent of Cercospora leaf spot of olives. Eur. J. Plant Pathol. 156: 45-65.
Ávila, A., Groenewald, J., Trapero, A., Crous, P. 2005. Characterisation and epitypification of Pseudocercospora cladosporioides, the causal organism of Cercospora leaf spot of olives. Mycol. Research 109: 881-888.
Crous, P.W., Braun, U., Hunter, G. C., Wingfield, M. J., Verkley, G. J. M., Shin, H. D., Nakashima, C., Groenewald, J. Z. 2013. Phylogenetic lineages in Pseudocercospora. Stud. Mycol. 75: 37–114.
Del Moral, J., Medina, D. 1985. El «repilo plomizo» del olivo causado por Cercospora cladosporioides Sacc., enfermedad presente en España. Bol. San. Veg. Plagas 12: 31-35.
García-Figueres, F. 1991. Repilos del olivo: ataque en fruto. Phytoma España 25: 31-36.
Moral, J., Alsalimiya, M., Roca, L.F., Díez, C., León, L., De la Rosa, R., Barranco, D., Rallo, L., Trapero, A. 2015. Relative susceptibility of new olive cultivars to Spilocaea oleagina, Colletotrichum acutatum, and Pseudocercospora cladosporioides. Plant Dis. 99:58-64.
Roca, L.F., Agustí-Brisach, C., Romero, J., Moral, J., Raya, M.C., Trapero, A. 2017. Diagnóstico y etiología de la «seca» de ramas de olivo (I y II). Vida Rural 437: 52-58 y 438: 48-53.
Roca, L.F., Viruega, J.R., Ávila, A., Oliveira, R., Marchal, F., Moral, J., Trapero, A. 2007. Los fungicidas cúpricos en el control de las enfermedades del olivo. Vida Rural 256: 52-56.
Romero, J., Ávila, A., Agustí-Brisach, C., Roca, L.F., Trapero, A. 2020. Evaluation of fungicides and management strategies against cercospora leaf spot of olive caused by Pseudocercospora cladosporioides. Agronomy 10: 271.
Romero, J., Roca, L.F., Agustí-Brisach, C., Trapero, A., González-Domínguez, E., Rossi, V. 2017. Sistema informático de apoyo al olivicultor: herramienta de toma de decisiones «Repilos». Phytoma 293:126-129.
Trapero, A., Agustí-Brisach, C., Romero, J., Moral, J., Roca, L.F. 2017a. Enfermedades emergentes en el olivar. Phytoma España 293: 26-32.
Trapero-Casas, A., López-Doncel, L.M., Viruega-Puente, J.R. 1998. Los repilos del olivo: etiología, epidemiología y estrategias de control. Phytoma España 102: 154-158.
Trapero, A., López-Escudero, F.J., Blanco, M.A. 2017b. Enfermedades. Barranco, D., Fernández-Escobar, R., Rallo, L. eds. El cultivo del olivo. 7ª edición. Mundi-Prensa, Madrid, 733-798 pp.