Chancros y seca de ramas
Botryosphaeriaceae
Categoría
Nombre de la enfermedad: Chancros, seca de ramas.
Tipo de enfermedad: Chancros o seca de ramas (en inglés “Canker” o “Branch dieback”).
Patógeno: Neofusicoccum mediterraneum (sinónimos: Botryosphaeria ribis). Hongo asexual, ecológicamente necrotrofo, con amplia gama de huéspedes leñosos, incluyendo Olea europaea. Se han descrito diversos hongos asociados con esta enfermedad, aunque N. mediterraneum se considera el principal agente causal.
Clasificación del patógeno: Fungi, Ascomycota, Dothideomycetes, Botryosphaeriales, Botryosphaeriaceae.
Diagnóstico: Enfermedad de diagnóstico complejo en base a los síntomas externos, ya que pueden confundirse con otras alteraciones bióticas o abióticas que causen síntomas similares. Requiere de técnicas de aislamiento microbiológico y moleculares para la correcta identificación del patógeno.
Ciclo biológico: Enfermedad monocíclica, con ninguno o pocos ciclos secundarios de infección anuales, el patógeno sobrevive y se desarrolla en la madera afectada o en restos de poda que quedan en el campo, se dispersa por viento y lluvia, y requiere heridas mecánicas para infectar.
Métodos de control: Gestión integrada que incluye prácticas culturales, y tratamientos fungicidas preventivos destinados a la protección de heridas (triazoles y/o estrobilurinas). Los productos cúpricos no son efectivos y tampoco se dispone de medidas específicas de control biológico.
Comparte en redes sociales:










Los chancros y la seca de ramas de olivo son conocidos desde finales del siglo XIX. La primera descripción de estos síntomas fue realizada por Saccardo en 1892 en Italia. Este síndrome se ha considerado tradicionalmente como una enfermedad secundaria en el olivar, y poco estudiada a lo largo del siglo XX. Los cambios en las prácticas culturales que se han dado en el olivar en las últimas décadas debido a intensificación del cultivo, principalmente la mecanización en la recolección y poda que incrementan las heridas en ramas y tronco, ha propiciado un aumento considerable de la incidencia de esta enfermedad en las principales regiones olivares del mundo, considerándose actualmente como una enfermedad emergente (Trapero et al., 2017; Agustí-Brisach et al., 2022). En España, son escasos los estudios sobre chancros y seca de ramas en el olivar, que se describieron por primera vez en Andalucía en 2005 (Romero et al., 2005). Desde ese momento se ha constatado un incremento general de la incidencia de la enfermedad, observándose una mayor severidad en la variedad de aceituna de mesa ‘Gordal Sevillana’, principalmente en plantaciones localizadas en la provincia de Sevilla (Moral et al., 2017). Recientemente, se han observado síntomas de seca de ramillas en olivares en seto, afectando especialmente a la variedad ‘Arbequina’ (Agustí-Brisach et al., 2021). La consecuencia más importante de la enfermedad es la desecación de brotes o incluso ramas enteras, que debilitan el árbol disminuyendo la productividad. Actualmente, no se conocen datos sobre las pérdidas de cosecha debidas a esta enfermedad.
Los árboles afectados muestran abundantes ramillas con brotes muertos y hojas marchitas o secas (Fig. 1). Las ramitas afectadas muestran brotes secos y muertos y una decoloración de la madera en sentido descendente desde el punto de infección (Fig. 2), permaneciendo adheridas a las ramas afectadas del árbol en las que se desarrollan chancros de diversa tipología (Fig. 3). Los chancros empiezan a desarrollarse desde el punto de infección (herida) tanto en sentido ascendente como descendente, mostrando áreas deprimidas, y decoloración de la madera (Fig. 3A-C). En estados muy avanzados, la madera puede agrietarse observándose heridas longitudinales a lo largo de la zona afectada (Fig. 1D) sobre la que se desarrollan cuerpos fructíferos (picnidios) del patógeno (Fig. 4). Si cortamos secciones transversales de la madera afectada se observan necrosis sectoriales en el interior con consistencia dura y tonalidades de marrón claro a negro (Fig. 5) (Moral et al., 2017; Úrbez-Torres et al., 2013). También en ocasiones pueden observarse punteaduras y estrías negras correspondientes a vasos xilemáticos necrosados como consecuencia del ataque de alguno de los hongos asociados a la enfermedad que presentan carácter vascular (Fig. 6) (Agustí-Brisach et al., 2021). Dentro del complejo de síntomas de desecación de ramas, existen hongos que colonizan preferentemente los tejidos parenquimáticos (corteza), causando los típicos chancros, y otros que colonizan los tejidos xilemáticos (madera), dando lugar a desecaciones de ramas sin chancros, aunque también se han descrito casos intermedios.
El correcto diagnóstico de la enfermedad es fundamental para trabajar con éxito en la identificación del patógeno o de los patógenos, así como en los posteriores estudios sobre su biología, epidemiología y control. En el caso de los chancros y la seca de ramas, el diagnóstico es muy complejo debido a la escasa especificidad de los síntomas y a la multitud de agentes que pueden estar asociados a estos síntomas. Por tanto, para un diagnóstico preciso se requiere del aislamiento de los hongos en medio de cultivo a partir de las muestras afectadas, y su posterior identificación tanto en base a caracteres morfológicos como moleculares. El uso de técnicas de biología molecular mediante la secuenciación de regiones génicas específicas (ITS, β-tubulina, factor de elongación 1-α, actina, etc.) del ADN de los hongos aislados permite identificar todos estos patógenos a nivel de especie.
Los hongos asociados a las desecaciones de ramas de olivo son conocidos desde finales del s. XIX (Saccardo, 1892). Los primeros síntomas de chancros y seca de ramas de olivo fueron descritos en Italia en 1892 asociados con especies de Phoma. Durante el s. XX, estas enfermedades han tenido escasa importancia existiendo sólo referencias en Italia, y en Grecia, donde se describieron por primera vez las siguientes especies fúngicas asociadas con la enfermedad: Comoclathris incompta (=Phoma incompta) (Malathrakis, 1979), Phaeoacremonium parasiticum (=Phialophora parasitica) (Thanassoulopoulos y Thanassoulopoulos, 1984), Cytospora oleina (Rumbos, 1988) y Eutypa lata (Rumbos, 1993). En España, hasta principios del s. XXI no existían referencias específicas de la presencia de estos patógenos, con la excepción de citas esporádicas de diversos hongos, posiblemente saprófitos, asociados con ramas secas de olivo (González-Fragoso, 1916; Fisher et al., 1992).
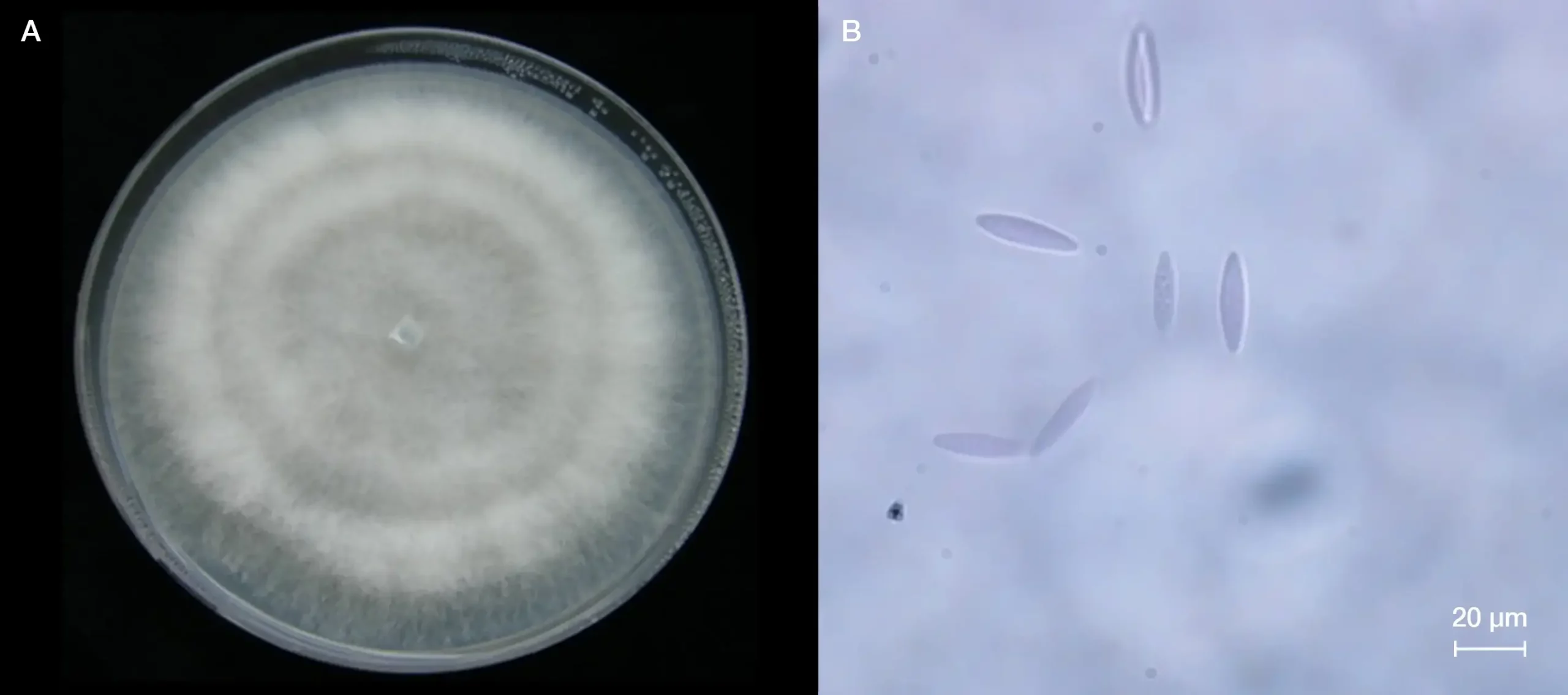
El incremento de la incidencia de estas enfermedades a partir de los 2000s, sumado al avance en las técnicas de biología molecular, ha derivado en que actualmente se hayan descrito más de 40 especies de hongos pertenecientes a diferentes géneros asociados a la seca de ramas de olivo, de las cuales la gran mayoría pertenecen a los géneros Botryosphaeria y Neofusicoccum, de la familia Botryosphaeriaceae (Moral et al., 2017; Carlucci et al., 2013b; Úrbez-Torres et al., 2013). Dentro de esta familia, la especie Neofusicoccum luteum se describió causando chancros en olivo en Nueva Zelanda (Taylor et al., 2001), y causando necrosis en hojas en Australia (Sergeeva et al., 2009). Las especies Diplodia mutila, D. seriata, Dothiorella iberica, Lasiodiplodia theobromae, N. luteum, N. parvum, N. stellenboschiana y N. vitifusiforme también han sido identificadas como agentes causales de estas enfermedades en regiones olivareras de Italia y California (Moral et al., 2010; Carlucci et al., 2013b; Úrbez-Torres et al., 2013; Manetti et al., 2023). En España, N. mediterraneum es la principal especie asociada a chancros y desecación de ramas de olivo afectando principalmente a la variedad ‘Gordal Sevillana’. Este patógeno se caracteriza por desarrollar colonias de micelio algodonoso, de crecimiento rápido, con tonalidades grises, y por producir conidios hialinos y fusiformes (Fig. 7) (Moral et al., 2017).
Algunas especies de la familia Botryosphaeriaceae afectan también al fruto maduro causando podredumbres, como D. olivarum, D. seriata y N. luteum, que se han descrito en aceituna madura en Italia, España y Australia, respectivamente. Sin embargo, debido a la alta resistencia que muestran las aceitunas verdes frente al ataque de hongos, no se han descrito patógenos importantes de esta familia que afecten a frutos inmaduros a excepción de la especie Botryosphaeria dothidea, agente causal de la enfermedad conocida como ‘Escudete’, que afecta exclusivamente a las aceitunas (Moral et al., 2008; 2010).
Además de los hongos de la familia Botryosphaeriaceae, existe una gran diversidad de hongos de diferentes géneros que también se han descrito asociados a los chancros y seca de ramas de olivo en los principales países olivareros. Entre ellas, podemos destacar las especies Calospora oleicola, Comoclathris incompta, Cytospora oleina, C. pruinosa, Diaporthe viticola, Diatrype oregonensis, Diat. stigma, Eutypa lata, Nothophoma quercina, Phaeoacremonium spp., Phaeomoniella chlamydospora, Phoma spp., Phomopsis spp., Pleurostomophora richardsiae, Schizophyllum commune y Trametes versicolor (Frisullo y Carlucci, 2011; Úrbez-Torres et al., 2013; Moral et al., 2017). Recientemente, a partir de síntomas de seca de ramillas en olivares en seto de la variedad Arbequina localizados en Andalucía, se han descrito los siguientes hongos vasculares asociados también con este síndrome: Acremonium sclerotigenum, Cadophora luteo-olivacea, Paracremonium sp., Phaeoacremonium italicum, Pm. minimum, Pm. parasiticum, Pm. scolyti y Pseudophaemoniella oleicola, siendo la especie Ca. luteo-olivacea la más virulenta en los ensayos de patogenicidad en olivo (Agustí-Brisach et al., 2021).
Para todas estas especies fúngicas, así como para algunas especies de Botryosphaeriaceae, no está claro si pueden considerarse patógenos primarios de la enfermedad, o bien actúan como endófitos o agentes secundarios causando infección o incrementando la severidad de los síntomas una vez se ha producido la infección por parte de los principales agentes causales de la enfermedad, considerando éstos como algunos hongos de la familia Botryosphaeriaceae, o bien, otros agentes causales asociados con otras enfermedades del olivar. En este sentido, estudios llevados a cabo en la región del sur de Apulia (Italia) demuestran que algunas de estas especies fúngicas están asociadas con los ataques de la bacteria Xylella fastidiosa en olivos jóvenes y adultos. Especies de hongos como N. parvum, N. stellenboschiana, Ps. oleae, Ps. oleicola, Pl. richardsiae y numerosas especies de Phaeoacremonium han sido aisladas de tejidos xilemáticos necrosados de ramas de olivo infectadas por X. fastidiosa (Nigro et al., 2013; 2015; Carlucci et al. 2013a; 2015; Manetti et al., 2023). Esto pone de manifiesto la necesidad de estudiar la posible interacción entre X. fastidiosa y los hongos que afectan a la madera del olivo, ya que la presencia mixta de todos estos patógenos podría inducir un desarrollo más rápido del debilitamiento y decaimiento de los olivos afectados.
Es importante destacar que en el olivar podemos encontrar síndromes de seca de ramas asociados tanto con otros agentes bióticos distintos a los citados (Colletotrichum spp. causante de antracnosis, Verticillium dahliae causante de verticilosis, especies de Phytophthora, Rosellinia, Armillaria causantes de podredumbres radicales, y especies de Fomes, Ganoderma, Phellinus causantes de caries del tronco) como por factores abióticos (frío, heladas, daño por roedores, etc.) que podrían confundirse con estas enfermedades, aunque en estos casos la ausencia de chancros y la afectación generalizada de la copa de los árboles son características diferenciales para su diagnóstico (Roca et al., 2017).
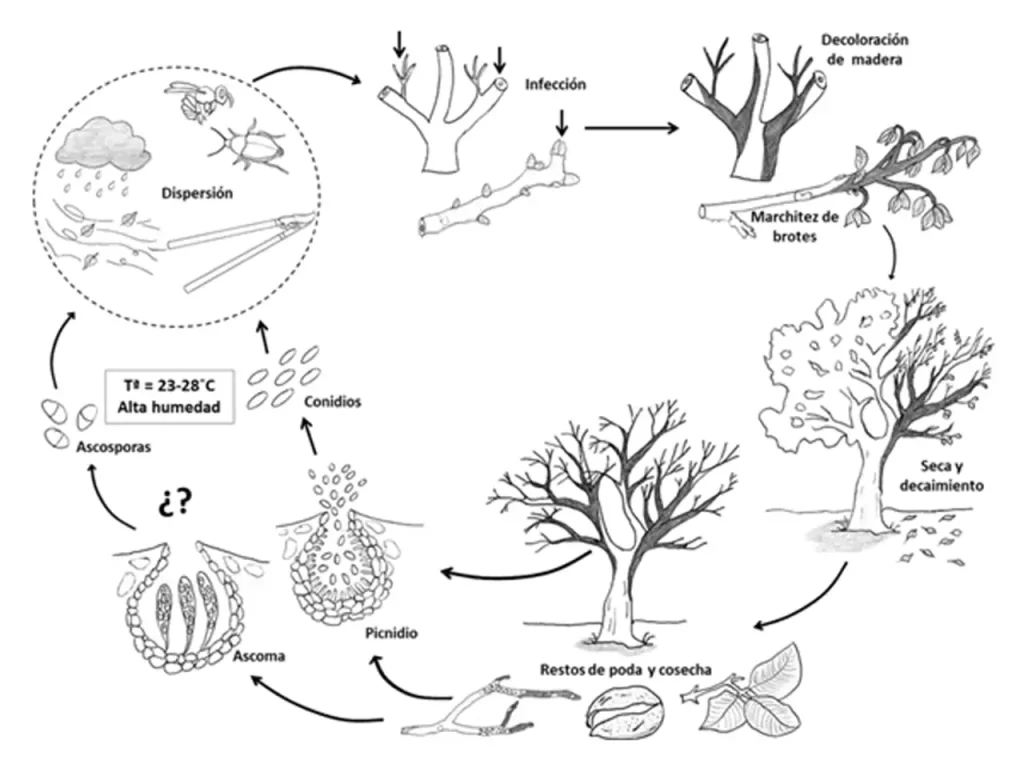
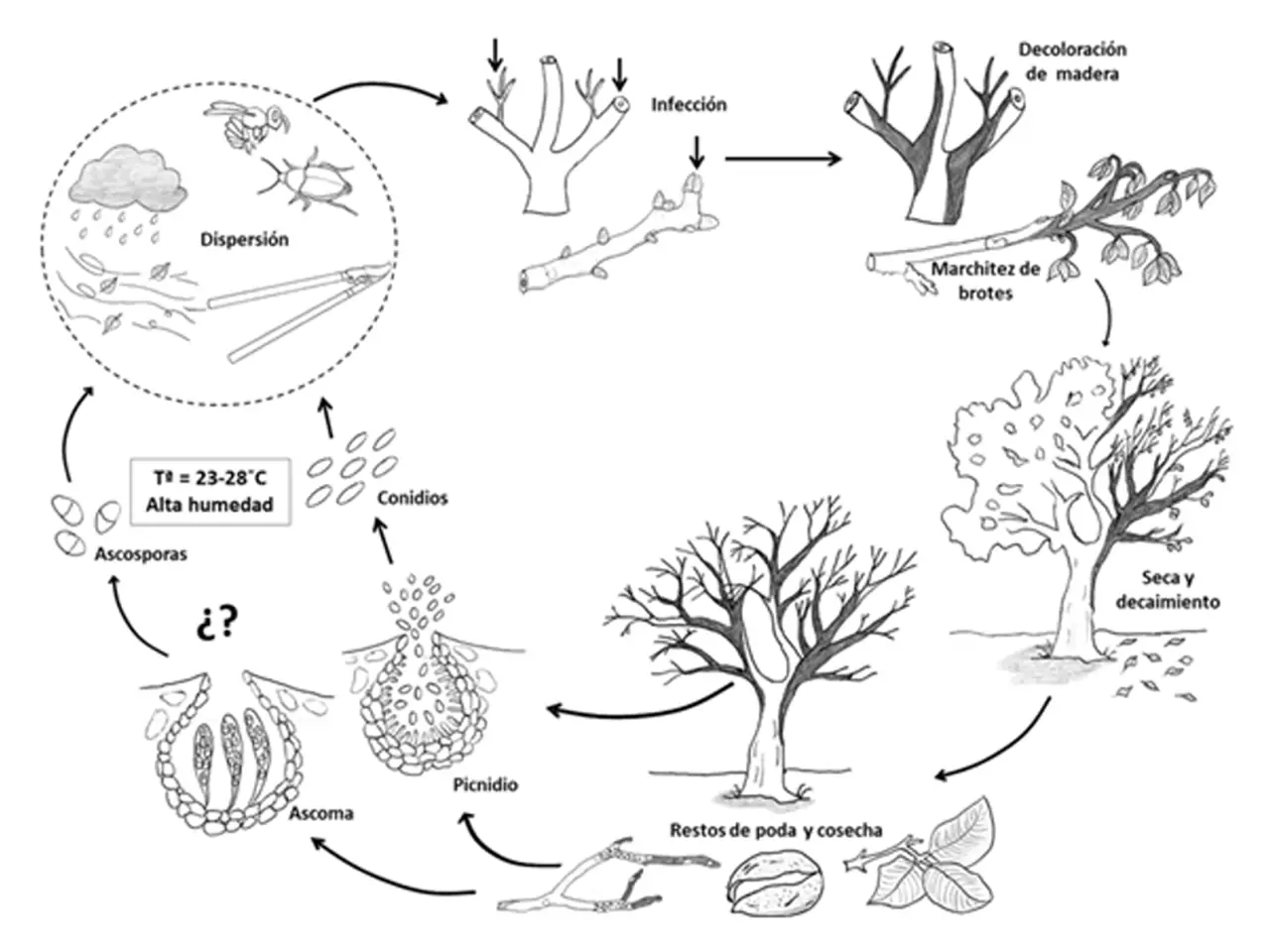
Debido a la diversidad de hongos asociados con la enfermedad, se muestra un ciclo biológico genérico de hongos de la familia Botryosphaeriaceae en cultivos leñosos (Fig. 8). El ciclo biológico de estos hongos se basa fundamentalmente en su estado asexual a través de la dispersión aérea de conidios. El estado sexual de estos hongos raras veces se encuentra en la naturaleza. A día de hoy, solo se ha identificado el estado sexual de las especies B. dothidea y N. mediterraneum en California y España, respectivamente (Moral et al., 2010; 2015).
Los conidios son producidos en los picnidios (cuerpos fructíferos) desarrollados por el hongo en la madera afectada cuando las condiciones de temperatura y humedad son adecuadas. La temperatura juega un papel importante en la germinación de los conidios. Por tanto, cuando las temperaturas son óptimas (25-27º C), estos son liberados de los picnidios y se dispersan por el aire, la lluvia o incluso a través de insectos vectores. La infección primaria de los olivos ocurre a través de las heridas ocasionadas en el árbol como consecuencia de las labores de poda, recolección, caída natural de hojas, o daños causados por insectos o granizo. Los conidios llegan a la superficie dañada, germinan y penetran en el interior de la planta a través de los tejidos heridos (Úrbez-Torres et al., 2010). Tras la infección, la fase de latencia de estos hongos puede ser muy prolongada, comportándose como endófitos en muchos casos. El cambio de la fase endofítica a la patogénica parece determinado por diversos factores ambientales. Tras la aparición de los síntomas, el inóculo de estos hongos puede estar presente en el olivar durante largos periodos de tiempo, tanto durante la etapa de parada vegetativa como durante las etapas de crecimiento del olivo, especialmente cuando las condiciones ambientales son favorables para la producción y dispersión de conidios. Debido a la susceptibilidad de las heridas de poda a la infección de hongos asociados con esta enfermedad, en ocasiones podemos encontrarnos un patrón de dispersión a lo largo de las líneas de cultivo como consecuencia de la transmisión a través de las herramientas de poda en una misma línea. Además, estos patógenos pueden sobrevivir largos periodos de tiempo, conservándose activos o en estado latente en los restos de poda que permanecen en el campo. Por ello, la práctica cada vez más generalizada en el olivar de utilizar los restos de poda como cubierta inerte del suelo favorece a estas enfermedades mediante el aumento de las fuentes de inóculo de los patógenos.
Métodos legislativos Ninguno de los hongos asociados con chancros y seca de ramas del olivar está clasificado como organismo de cuarentena por la EPPO. Por su parte, el programa de certificación de planta de vivero tampoco considera ninguno de estos hongos para su control durante el proceso de propagación de planta de vivero.
Prácticas culturales La principal estrategia de control a considerar para evitar la emergencia de chancros y seca de ramas en el olivar es la prevención de la infección de los patógenos descritos a través de las heridas realizadas durante la poda y la recolección, principalmente. En este sentido, se recomienda realizar un manejo adecuado y cuidadoso de las herramientas utilizadas, así como su desinfestación continua, evitando la realización de un gran número de heridas en ramas y troncos, así como la transmisión del patógeno entre árboles afectados y sanos. A su vez, se recomienda proteger las heridas producidas mediante tratamientos químicos como más adelante comentaremos, impidiendo o reduciendo la infección por estos patógenos (Agustí-Brisach et al., 2017).
Se recomienda la realización de podas de saneamiento cortando las ramas afectadas, así como la eliminación de los restos de poda del campo para reducir fuentes de inóculo, previniendo así infecciones futuras en olivares sanos y la disminución de la incidencia de estas enfermedades en los olivares afectados (Agustí-Brisach et al., 2017).
El estado hídrico del olivo también es un factor clave en la incidencia de estas enfermedades. Es bien conocido que las situaciones de estrés hídrico pueden inducir una mayor incidencia de este tipo de enfermedades en los cultivos leñosos (Schoeneweiss, 1981), incluyendo el olivar (Úrbez-Torres et al., 2013). Por lo que se recomienda, en la medida de lo posible, evitar situaciones de déficit hídrico durante periodos prolongados de tiempo.
Resistencia genética Los estudios de resistencia genética frente a los hongos que causan chancros y seca de ramas son escasos o prácticamente nulos en el olivar. Los únicos estudios que disponemos se realizaron inoculando ramas cortadas y plantones de olivo de las principales variedades de aceituna de mesa con los principales hongos asociados con la enfermedad descritos en Andalucía. Los resultados mostraron que ‘Gordal Sevillana’ es la variedad más susceptible a este patógeno, seguida de otras variedades como ‘Manzanilla cacereña’; mientras que ‘Arbequina’, ‘Manzanilla de Sevilla’ y ‘Picual’ se clasificaron como tolerantes o poco susceptibles a la enfermedad, demostrándose que hay una clara influencia varietal en la severidad de la enfermedad (Moral et al., 2017).
Control biológico A día de hoy, no se ha demostrado la eficacia de métodos de control biológico para el control de los hongos asociados con chancros y seca de ramas del olivar.
Control químico Los estudios llevados a cabo sobre control químico de esta enfermedad son escasos hasta el momento. En ensayos in vitro, se ha observado que los triazoles, o la mezclas de estrobilurinas con triazoles u otras familias químicas, tienen un efecto significativo en la reducción del crecimiento micelial de N. mediterraneum, mientras que los productos cúpricos no tienen ningún efecto significativo en el control del patógeno. Estos resultados todavía no se han evaluado y contrastado en campo, aspecto necesario para poder desarrollar estrategias óptimas de control. No obstante, se recomienda proteger las heridas de poda con mástics y/o tratamientos fungicidas con triazoles y estrobilurinas justo tras la realización de las heridas.
Agustí-Brisach, C., Moral, J., Pérez-Rodríguez, M., Roca, L.F., Raya, M.C., Romero, J., Trapero, A. 2017. Etiología y perspectivas de control de los chancros y desecaciones de ramas de olivo causados por hongos. PHYTOMA España 292: 1-6.
Agustí-Brisach, C., Moral, J., Jiménez-Urbano, J.P., Raya, M.C., Roca, L.F., López-Moral, A., Romero, J., Trapero, A. Chancros y seca de ramas, un síndrome emergente en el olivar. PHYTOMA España 343: 87-92.
Carlucci, A., Lops, F., Marchi, G., Mugnai, L., Surico, G. 2013a. Has Xylella fastidiosa “chosen” olive trees to establish in the Mediterranean basin? Phytopath. Medit. 52: 541-544.
Carlucci, A., Raimondo, M.L., Cibelli, F., Phillips, J.L., Lops, F. 2013b. Pleurostomophora richardsiae, Neofusicoccum parvum and Phaeoacremonium aleophilum associated with a decline of olives in southern Italy. Phytopath. Medit. 52: 517-527.
Carlucci, A., Lops, F., Cibelli, F., Raimondo, M.L. 2015. Phaeoacremonium species associated with olive wilt and decline in southern Italy. Eur. J. Plant Pathol. 141: 717-729.
Fisher, P.J., Petrini, O., Petrini, L.E., Descals, E., 1992. A preliminary study of fungi inhabiting xylem and whole stems of Olea europaea. Sydowia 44: 117-121.
Frisullo S., Carlucci A. 2011. Minor fungal diseases of olive. In: Olive Diseases and Disorders. L. Schena, G.E. Agosteo, S.O. Cacciola, eds. Transworld Research Network, Kerala, India, 291-304.
González-Fragoso, R., 1916. Bosquejo de una flórula hispalense de micromicetos. Trab. del Mus. Nac. De Cienc. Nat. de Madrid, Serie Bot. 10: 1-221.
Lovera, M., López-Moral, A., Raya, M.C., Cortés-Cosano, N., Arquero, O., Trapero, A., Agustí-Brisach, C., 2019. Etiología de la seca de ramas y marchitez de brotes del nogal en el sur de España. Fruticultura, 72: 6-19.
Malathrakis N.E., 1979. Studies on a disease of olive due to fungus Phoma incompta Sacc. & Mart. Ph.D. diss. University of Athens, Greece.
Manetti, G., Brunetti, A., Lumia, V., Sciarroni, L., Marangi, P., Cristella, N., Faggioli, F., Reverberi, M., Scortichini, M., Pilott, M. 2023. Identification and Characterization of Neofusicoccum stellenboschiana in Branch and Twig Dieback-Affected Olive Trees in Italy and Comparative Pathogenicity with N. mediterraneum. J. Fungi 9: 292.
Moral, J., Agustí-Brisach, C., Pérez Rodríguez, M., Xavíer, C., Raya, M.C., Rhouma, A., Trapero, A. 2017. Identification of fungal species associated with branch dieback of olive and resistance of table cultivars to Neofusicoccum mediterraneum and Botryosphaeria dothidea. Plant Dis. 101: 306-316.
Moral J., Luque F. Trapero, A. 2008. First report of Diplodia seriata, the anamorph of “Botryosphaeria” obtusa, causing fruit rot of olive in Spain. Plant Dis. 92: 311.
Moral J., Muñoz-Díez C., González N., Trapero A. Michailides T.J. 2010. Characterization and pathogenicity of Botryosphaeriaceae species collected from olive and other hosts in Spain and California. Phytopathology 100: 1340-1351.
Moral J., Pérez-Rodríguez M, Michailides T.J., Trapero A. 2015. First report of the teleomorph of Neofusicoccum mediterraneum, a pathogen of olive. Phytopathology 105: 97-98.
Nigro F, Antelmi I., Crous P.W. 2015. Pseudophaeomoniella oleae & Pseudophaeomoniella oleicola. Persoonia 34: 224-227.
Nigro, F., Boscia, D., Antelmi, I. Ippolito, A., 2013. Fungal species associated with a severe decline of olive in southern Italy. J. Plant Pathol. 65: 659-668.
Roca, L. F., Agustí-Brisach, C., Romero, J., Moral, J., Raya-Ortega, M.C., Trapero, A., 2017. Diagnóstico y etiología de la ‘seca’ de ramas de olivo. Vida Rural 437, 439: 52-58, 48-53.
Romero, M.A, Sánchez, M.E., Trapero, A. 2005. First report of Botryosphaeria ribis as a branch dieback pathogen of olive trees in Spain. Plant Dis. 89: 208.
Rumbos, I.C., 1988. Cytospora oleina causing canker and dieback of olive in Greece. Plant Pathol. 37: 441-444.
Rumbos, I.C., 1993. Dieback symptoms on olive trees caused by the fungus Eutypa lata. EPPO Bull. 23: 441-445.
Saccardo P.A. 1892. Sylloge Fungorum 10. Padua, Italia, pp. 1-964.
Schoeneweiss D.F. 1981. The role of environmental stress in diseases of woody plants. Plant Dis. 65: 308-314.
Sergeeva V., Alves A. Phillips A.J.L., 2009. Neofusicoccum luteum associated with leaf necrosis and fruit rot of olives in New South Wales, Australia. Phytopath. Medit. 48: 294-298.
Taylor R.K., Hale C.N. Hartill, W.F.T. 2001. A stem canker disease of olive (Olea europaea) in New Zealand. New Zealand J. Crop and Hortic. Sci. 29: 219-228.
Thanassoulopoulos, C.C., Thanassoulopoulos, A., 1984. Phialophora parasitica, a new olive parasite associated to bark beetles. Phytopath. Medit. 23: 47-48.
Trapero, A., Agustí-Brisach, C., Romero, J., Moral, J., Roca, L.F. 2017. Enfermedades emergentes en el olivar. PHYTOMA España 293: 26-32.
Úrbez-Torres, J.R., Peduto, F., Vossen, P.M., Krueger, W.H., Gubler, W.D. 2013. Olive twig and branch dieback: Etiology, incidence, and distribution in California. Plant Dis. 97: 231-244.
Los chancros y la seca de ramas de olivo son conocidos desde finales del siglo XIX. La primera descripción de estos síntomas fue realizada por Saccardo en 1892 en Italia. Este síndrome se ha considerado tradicionalmente como una enfermedad secundaria en el olivar, y poco estudiada a lo largo del siglo XX. Los cambios en las prácticas culturales que se han dado en el olivar en las últimas décadas debido a intensificación del cultivo, principalmente la mecanización en la recolección y poda que incrementan las heridas en ramas y tronco, ha propiciado un aumento considerable de la incidencia de esta enfermedad en las principales regiones olivares del mundo, considerándose actualmente como una enfermedad emergente (Trapero et al., 2017; Agustí-Brisach et al., 2022). En España, son escasos los estudios sobre chancros y seca de ramas en el olivar, que se describieron por primera vez en Andalucía en 2005 (Romero et al., 2005). Desde ese momento se ha constatado un incremento general de la incidencia de la enfermedad, observándose una mayor severidad en la variedad de aceituna de mesa ‘Gordal Sevillana’, principalmente en plantaciones localizadas en la provincia de Sevilla (Moral et al., 2017). Recientemente, se han observado síntomas de seca de ramillas en olivares en seto, afectando especialmente a la variedad ‘Arbequina’ (Agustí-Brisach et al., 2021). La consecuencia más importante de la enfermedad es la desecación de brotes o incluso ramas enteras, que debilitan el árbol disminuyendo la productividad. Actualmente, no se conocen datos sobre las pérdidas de cosecha debidas a esta enfermedad.
Los árboles afectados muestran abundantes ramillas con brotes muertos y hojas marchitas o secas (Fig. 1).
Las ramitas afectadas muestran brotes secos y muertos y una decoloración de la madera en sentido descendente desde el punto de infección (Fig. 2), permaneciendo adheridas a las ramas afectadas del árbol en las que se desarrollan chancros de diversa tipología (Fig. 3).
Los chancros empiezan a desarrollarse desde el punto de infección (herida) tanto en sentido ascendente como descendente, mostrando áreas deprimidas, y decoloración de la madera (Fig. 3A-C). En estados muy avanzados, la madera puede agrietarse observándose heridas longitudinales a lo largo de la zona afectada (Fig. 3D) sobre la que se desarrollan cuerpos fructíferos (picnidios) del patógeno (Fig. 4).
Si cortamos secciones transversales de la madera afectada se observan necrosis sectoriales en el interior con consistencia dura y tonalidades de marrón claro a negro (Fig. 5) (Moral et al., 2017; Úrbez-Torres et al., 2013). También en ocasiones pueden observarse punteaduras y estrías negras correspondientes a vasos xilemáticos necrosados como consecuencia del ataque de alguno de los hongos asociados a la enfermedad que presentan carácter vascular (Fig. 6) (Agustí-Brisach et al., 2021). Dentro del complejo de síntomas de desecación de ramas, existen hongos que colonizan preferentemente los tejidos parenquimáticos (corteza), causando los típicos chancros, y otros que colonizan los tejidos xilemáticos (madera), dando lugar a desecaciones de ramas sin chancros, aunque también se han descrito casos intermedios.
El correcto diagnóstico de la enfermedad es fundamental para trabajar con éxito en la identificación del patógeno o de los patógenos, así como en los posteriores estudios sobre su biología, epidemiología y control. En el caso de los chancros y la seca de ramas, el diagnóstico es muy complejo debido a la escasa especificidad de los síntomas y a la multitud de agentes que pueden estar asociados a estos síntomas. Por tanto, para un diagnóstico preciso se requiere del aislamiento de los hongos en medio de cultivo a partir de las muestras afectadas, y su posterior identificación tanto en base a caracteres morfológicos como moleculares. El uso de técnicas de biología molecular mediante la secuenciación de regiones génicas específicas (ITS, β-tubulina, factor de elongación 1-α, actina, etc.) del ADN de los hongos aislados permite identificar todos estos patógenos a nivel de especie.
Los hongos asociados a las desecaciones de ramas de olivo son conocidos desde finales del s. XIX (Saccardo, 1892). Los primeros síntomas de chancros y seca de ramas de olivo fueron descritos en Italia en 1892 asociados con especies de Phoma. Durante el s. XX, estas enfermedades han tenido escasa importancia existiendo sólo referencias en Italia, y en Grecia, donde se describieron por primera vez las siguientes especies fúngicas asociadas con la enfermedad: Comoclathris incompta (=Phoma incompta) (Malathrakis, 1979), Phaeoacremonium parasiticum (=Phialophora parasitica) (Thanassoulopoulos y Thanassoulopoulos, 1984), Cytospora oleina (Rumbos, 1988) y Eutypa lata (Rumbos, 1993). En España, hasta principios del s. XXI no existían referencias específicas de la presencia de estos patógenos, con la excepción de citas esporádicas de diversos hongos, posiblemente saprófitos, asociados con ramas secas de olivo (González-Fragoso, 1916; Fisher et al., 1992).
El incremento de la incidencia de estas enfermedades a partir de los 2000s, sumado al avance en las técnicas de biología molecular, ha derivado en que actualmente se hayan descrito más de 40 especies de hongos pertenecientes a diferentes géneros asociados a la seca de ramas de olivo, de las cuales la gran mayoría pertenecen a los géneros Botryosphaeria y Neofusicoccum, de la familia Botryosphaeriaceae (Moral et al., 2017; Carlucci et al., 2013b; Úrbez-Torres et al., 2013). Dentro de esta familia, la especie Neofusicoccum luteum se describió causando chancros en olivo en Nueva Zelanda (Taylor et al., 2001), y causando necrosis en hojas en Australia (Sergeeva et al., 2009). Las especies Diplodia mutila, D. seriata, Dothiorella iberica, Lasiodiplodia theobromae, N. luteum, N. parvum, N. stellenboschiana y N. vitifusiforme también han sido identificadas como agentes causales de estas enfermedades en regiones olivareras de Italia y California (Moral et al., 2010; Carlucci et al., 2013b; Úrbez-Torres et al., 2013; Manetti et al., 2023). En España, N. mediterraneum es la principal especie asociada a chancros y desecación de ramas de olivo afectando principalmente a la variedad ‘Gordal Sevillana’. Este patógeno se caracteriza por desarrollar colonias de micelio algodonoso, de crecimiento rápido, con tonalidades grises, y por producir conidios hialinos y fusiformes (Fig. 7) (Moral et al., 2017).
Algunas especies de la familia Botryosphaeriaceae afectan también al fruto maduro causando podredumbres, como D. olivarum, D. seriata y N. luteum, que se han descrito en aceituna madura en Italia, España y Australia, respectivamente. Sin embargo, debido a la alta resistencia que muestran las aceitunas verdes frente al ataque de hongos, no se han descrito patógenos importantes de esta familia que afecten a frutos inmaduros a excepción de la especie Botryosphaeria dothidea, agente causal de la enfermedad conocida como ‘Escudete’, que afecta exclusivamente a las aceitunas (Moral et al., 2008; 2010).
Además de los hongos de la familia Botryosphaeriaceae, existe una gran diversidad de hongos de diferentes géneros que también se han descrito asociados a los chancros y seca de ramas de olivo en los principales países olivareros. Entre ellas, podemos destacar las especies Calospora oleicola, Comoclathris incompta, Cytospora oleina, C. pruinosa, Diaporthe viticola, Diatrype oregonensis, Diat. stigma, Eutypa lata, Nothophoma quercina, Phaeoacremonium spp., Phaeomoniella chlamydospora, Phoma spp., Phomopsis spp., Pleurostomophora richardsiae, Schizophyllum commune y Trametes versicolor (Frisullo y Carlucci, 2011; Úrbez-Torres et al., 2013; Moral et al., 2017). Recientemente, a partir de síntomas de seca de ramillas en olivares en seto de la variedad Arbequina localizados en Andalucía, se han descrito los siguientes hongos vasculares asociados también con este síndrome: Acremonium sclerotigenum, Cadophora luteo-olivacea, Paracremonium sp., Phaeoacremonium italicum, Pm. minimum, Pm. parasiticum, Pm. scolyti y Pseudophaemoniella oleicola, siendo la especie Ca. luteo-olivacea la más virulenta en los ensayos de patogenicidad en olivo (Agustí-Brisach et al., 2021).
Para todas estas especies fúngicas, así como para algunas especies de Botryosphaeriaceae, no está claro si pueden considerarse patógenos primarios de la enfermedad, o bien actúan como endófitos o agentes secundarios causando infección o incrementando la severidad de los síntomas una vez se ha producido la infección por parte de los principales agentes causales de la enfermedad, considerando éstos como algunos hongos de la familia Botryosphaeriaceae, o bien, otros agentes causales asociados con otras enfermedades del olivar. En este sentido, estudios llevados a cabo en la región del sur de Apulia (Italia) demuestran que algunas de estas especies fúngicas están asociadas con los ataques de la bacteria Xylella fastidiosa en olivos jóvenes y adultos. Especies de hongos como N. parvum, N. stellenboschiana, Ps. oleae, Ps. oleicola, Pl. richardsiae y numerosas especies de Phaeoacremonium han sido aisladas de tejidos xilemáticos necrosados de ramas de olivo infectadas por X. fastidiosa (Nigro et al., 2013; 2015; Carlucci et al. 2013a; 2015; Manetti et al., 2023). Esto pone de manifiesto la necesidad de estudiar la posible interacción entre X. fastidiosa y los hongos que afectan a la madera del olivo, ya que la presencia mixta de todos estos patógenos podría inducir un desarrollo más rápido del debilitamiento y decaimiento de los olivos afectados.
Es importante destacar que en el olivar podemos encontrar síndromes de seca de ramas asociados tanto con otros agentes bióticos distintos a los citados (Colletotrichum spp. causante de antracnosis, Verticillium dahliae causante de verticilosis, especies de Phytophthora, Rosellinia, Armillaria causantes de podredumbres radicales, y especies de Fomes, Ganoderma, Phellinus causantes de caries del tronco) como por factores abióticos (frío, heladas, daño por roedores, etc.) que podrían confundirse con estas enfermedades, aunque en estos casos la ausencia de chancros y la afectación generalizada de la copa de los árboles son características diferenciales para su diagnóstico (Roca et al., 2017).
Debido a la diversidad de hongos asociados con la enfermedad, se muestra un ciclo biológico genérico de hongos de la familia Botryosphaeriaceae en cultivos leñosos (Fig. 8). El ciclo biológico de estos hongos se basa fundamentalmente en su estado asexual a través de la dispersión aérea de conidios. El estado sexual de estos hongos raras veces se encuentra en la naturaleza. A día de hoy, solo se ha identificado el estado sexual de las especies B. dothidea y N. mediterraneum en California y España, respectivamente (Moral et al., 2010; 2015).
Los conidios son producidos en los picnidios (cuerpos fructíferos) desarrollados por el hongo en la madera afectada cuando las condiciones de temperatura y humedad son adecuadas. La temperatura juega un papel importante en la germinación de los conidios. Por tanto, cuando las temperaturas son óptimas (25-27º C), estos son liberados de los picnidios y se dispersan por el aire, la lluvia o incluso a través de insectos vectores. La infección primaria de los olivos ocurre a través de las heridas ocasionadas en el árbol como consecuencia de las labores de poda, recolección, caída natural de hojas, o daños causados por insectos o granizo. Los conidios llegan a la superficie dañada, germinan y penetran en el interior de la planta a través de los tejidos heridos (Úrbez-Torres et al., 2010). Tras la infección, la fase de latencia de estos hongos puede ser muy prolongada, comportándose como endófitos en muchos casos. El cambio de la fase endofítica a la patogénica parece determinado por diversos factores ambientales. Tras la aparición de los síntomas, el inóculo de estos hongos puede estar presente en el olivar durante largos periodos de tiempo, tanto durante la etapa de parada vegetativa como durante las etapas de crecimiento del olivo, especialmente cuando las condiciones ambientales son favorables para la producción y dispersión de conidios. Debido a la susceptibilidad de las heridas de poda a la infección de hongos asociados con esta enfermedad, en ocasiones podemos encontrarnos un patrón de dispersión a lo largo de las líneas de cultivo como consecuencia de la transmisión a través de las herramientas de poda en una misma línea. Además, estos patógenos pueden sobrevivir largos periodos de tiempo, conservándose activos o en estado latente en los restos de poda que permanecen en el campo. Por ello, la práctica cada vez más generalizada en el olivar de utilizar los restos de poda como cubierta inerte del suelo favorece a estas enfermedades mediante el aumento de las fuentes de inóculo de los patógenos.
Métodos legislativos Ninguno de los hongos asociados con chancros y seca de ramas del olivar está clasificado como organismo de cuarentena por la EPPO. Por su parte, el programa de certificación de planta de vivero tampoco considera ninguno de estos hongos para su control durante el proceso de propagación de planta de vivero.
Prácticas culturales La principal estrategia de control a considerar para evitar la emergencia de chancros y seca de ramas en el olivar es la prevención de la infección de los patógenos descritos a través de las heridas realizadas durante la poda y la recolección, principalmente. En este sentido, se recomienda realizar un manejo adecuado y cuidadoso de las herramientas utilizadas, así como su desinfestación continua, evitando la realización de un gran número de heridas en ramas y troncos, así como la transmisión del patógeno entre árboles afectados y sanos. A su vez, se recomienda proteger las heridas producidas mediante tratamientos químicos como más adelante comentaremos, impidiendo o reduciendo la infección por estos patógenos (Agustí-Brisach et al., 2017).
Se recomienda la realización de podas de saneamiento cortando las ramas afectadas, así como la eliminación de los restos de poda del campo para reducir fuentes de inóculo, previniendo así infecciones futuras en olivares sanos y la disminución de la incidencia de estas enfermedades en los olivares afectados (Agustí-Brisach et al., 2017).
El estado hídrico del olivo también es un factor clave en la incidencia de estas enfermedades. Es bien conocido que las situaciones de estrés hídrico pueden inducir una mayor incidencia de este tipo de enfermedades en los cultivos leñosos (Schoeneweiss, 1981), incluyendo el olivar (Úrbez-Torres et al., 2013). Por lo que se recomienda, en la medida de lo posible, evitar situaciones de déficit hídrico durante periodos prolongados de tiempo.
Resistencia genética Los estudios de resistencia genética frente a los hongos que causan chancros y seca de ramas son escasos o prácticamente nulos en el olivar. Los únicos estudios que disponemos se realizaron inoculando ramas cortadas y plantones de olivo de las principales variedades de aceituna de mesa con los principales hongos asociados con la enfermedad descritos en Andalucía. Los resultados mostraron que ‘Gordal Sevillana’ es la variedad más susceptible a este patógeno, seguida de otras variedades como ‘Manzanilla cacereña’; mientras que ‘Arbequina’, ‘Manzanilla de Sevilla’ y ‘Picual’ se clasificaron como tolerantes o poco susceptibles a la enfermedad, demostrándose que hay una clara influencia varietal en la severidad de la enfermedad (Moral et al., 2017).
Control biológico A día de hoy, no se ha demostrado la eficacia de métodos de control biológico para el control de los hongos asociados con chancros y seca de ramas del olivar.
Control químico Los estudios llevados a cabo sobre control químico de esta enfermedad son escasos hasta el momento. En ensayos in vitro, se ha observado que los triazoles, o la mezclas de estrobilurinas con triazoles u otras familias químicas, tienen un efecto significativo en la reducción del crecimiento micelial de N. mediterraneum, mientras que los productos cúpricos no tienen ningún efecto significativo en el control del patógeno. Estos resultados todavía no se han evaluado y contrastado en campo, aspecto necesario para poder desarrollar estrategias óptimas de control. No obstante, se recomienda proteger las heridas de poda con mástics y/o tratamientos fungicidas con triazoles y estrobilurinas justo tras la realización de las heridas.
Agustí-Brisach, C., Moral, J., Pérez-Rodríguez, M., Roca, L.F., Raya, M.C., Romero, J., Trapero, A. 2017. Etiología y perspectivas de control de los chancros y desecaciones de ramas de olivo causados por hongos. PHYTOMA España 292: 1-6.
Agustí-Brisach, C., Moral, J., Jiménez-Urbano, J.P., Raya, M.C., Roca, L.F., López-Moral, A., Romero, J., Trapero, A. Chancros y seca de ramas, un síndrome emergente en el olivar. PHYTOMA España 343: 87-92.
Carlucci, A., Lops, F., Marchi, G., Mugnai, L., Surico, G. 2013a. Has Xylella fastidiosa “chosen” olive trees to establish in the Mediterranean basin? Phytopath. Medit. 52: 541-544.
Carlucci, A., Raimondo, M.L., Cibelli, F., Phillips, J.L., Lops, F. 2013b. Pleurostomophora richardsiae, Neofusicoccum parvum and Phaeoacremonium aleophilum associated with a decline of olives in southern Italy. Phytopath. Medit. 52: 517-527.
Carlucci, A., Lops, F., Cibelli, F., Raimondo, M.L. 2015. Phaeoacremonium species associated with olive wilt and decline in southern Italy. Eur. J. Plant Pathol. 141: 717-729.
Fisher, P.J., Petrini, O., Petrini, L.E., Descals, E., 1992. A preliminary study of fungi inhabiting xylem and whole stems of Olea europaea. Sydowia 44: 117-121.
Frisullo S., Carlucci A. 2011. Minor fungal diseases of olive. In: Olive Diseases and Disorders. L. Schena, G.E. Agosteo, S.O. Cacciola, eds. Transworld Research Network, Kerala, India, 291-304.
González-Fragoso, R., 1916. Bosquejo de una flórula hispalense de micromicetos. Trab. del Mus. Nac. De Cienc. Nat. de Madrid, Serie Bot. 10: 1-221.
Lovera, M., López-Moral, A., Raya, M.C., Cortés-Cosano, N., Arquero, O., Trapero, A., Agustí-Brisach, C., 2019. Etiología de la seca de ramas y marchitez de brotes del nogal en el sur de España. Fruticultura, 72: 6-19.
Malathrakis N.E., 1979. Studies on a disease of olive due to fungus Phoma incompta Sacc. & Mart. Ph.D. diss. University of Athens, Greece.
Manetti, G., Brunetti, A., Lumia, V., Sciarroni, L., Marangi, P., Cristella, N., Faggioli, F., Reverberi, M., Scortichini, M., Pilott, M. 2023. Identification and Characterization of Neofusicoccum stellenboschiana in Branch and Twig Dieback-Affected Olive Trees in Italy and Comparative Pathogenicity with N. mediterraneum. J. Fungi 9: 292.
Moral, J., Agustí-Brisach, C., Pérez Rodríguez, M., Xavíer, C., Raya, M.C., Rhouma, A., Trapero, A. 2017. Identification of fungal species associated with branch dieback of olive and resistance of table cultivars to Neofusicoccum mediterraneum and Botryosphaeria dothidea. Plant Dis. 101: 306-316.
Moral J., Luque F. Trapero, A. 2008. First report of Diplodia seriata, the anamorph of “Botryosphaeria” obtusa, causing fruit rot of olive in Spain. Plant Dis. 92: 311.
Moral J., Muñoz-Díez C., González N., Trapero A. Michailides T.J. 2010. Characterization and pathogenicity of Botryosphaeriaceae species collected from olive and other hosts in Spain and California. Phytopathology 100: 1340-1351.
Moral J., Pérez-Rodríguez M, Michailides T.J., Trapero A. 2015. First report of the teleomorph of Neofusicoccum mediterraneum, a pathogen of olive. Phytopathology 105: 97-98.
Nigro F, Antelmi I., Crous P.W. 2015. Pseudophaeomoniella oleae & Pseudophaeomoniella oleicola. Persoonia 34: 224-227.
Nigro, F., Boscia, D., Antelmi, I. Ippolito, A., 2013. Fungal species associated with a severe decline of olive in southern Italy. J. Plant Pathol. 65: 659-668.
Roca, L. F., Agustí-Brisach, C., Romero, J., Moral, J., Raya-Ortega, M.C., Trapero, A., 2017. Diagnóstico y etiología de la ‘seca’ de ramas de olivo. Vida Rural 437, 439: 52-58, 48-53.
Romero, M.A, Sánchez, M.E., Trapero, A. 2005. First report of Botryosphaeria ribis as a branch dieback pathogen of olive trees in Spain. Plant Dis. 89: 208.
Rumbos, I.C., 1988. Cytospora oleina causing canker and dieback of olive in Greece. Plant Pathol. 37: 441-444.
Rumbos, I.C., 1993. Dieback symptoms on olive trees caused by the fungus Eutypa lata. EPPO Bull. 23: 441-445.
Saccardo P.A. 1892. Sylloge Fungorum 10. Padua, Italia, pp. 1-964.
Schoeneweiss D.F. 1981. The role of environmental stress in diseases of woody plants. Plant Dis. 65: 308-314.
Sergeeva V., Alves A. Phillips A.J.L., 2009. Neofusicoccum luteum associated with leaf necrosis and fruit rot of olives in New South Wales, Australia. Phytopath. Medit. 48: 294-298.
Taylor R.K., Hale C.N. Hartill, W.F.T. 2001. A stem canker disease of olive (Olea europaea) in New Zealand. New Zealand J. Crop and Hortic. Sci. 29: 219-228.
Thanassoulopoulos, C.C., Thanassoulopoulos, A., 1984. Phialophora parasitica, a new olive parasite associated to bark beetles. Phytopath. Medit. 23: 47-48.
Trapero, A., Agustí-Brisach, C., Romero, J., Moral, J., Roca, L.F. 2017. Enfermedades emergentes en el olivar. PHYTOMA España 293: 26-32.
Úrbez-Torres, J.R., Peduto, F., Vossen, P.M., Krueger, W.H., Gubler, W.D. 2013. Olive twig and branch dieback: Etiology, incidence, and distribution in California. Plant Dis. 97: 231-244.